2023年2月10日,复旦大学附属华山医院王坚团队在《NPJ Parkinson’s Disease》杂志发表题为“Plasma GFAP in Parkinson's disease with cognitive impairment and its potential to predict conversion to dementia”的研究成果。本研究利用Simoa技术检测PD认知正常患者(PD-NC)、PD轻度认知功能障碍患者(PD-MCI)、PD痴呆患者(PDD)和健康对照组的血浆GFAP水平。PD-MCI患者进行了4.1 ± 2.3年的随访。与健康对照组相比,PDD和PD-MCI患者的血浆GFAP水平显著升高,并且与MMSE得分呈负相关。血浆GFAP预测MCI转为痴呆的AUC为0.90。该研究结果支持血浆GFAP水平预测PD-MCI转化为痴呆的潜在价值。
复旦大学附属华山医院王坚教授、左传涛教授团队在《Movement Disorders》杂志发表题为“18F-Florzolotau tau PET imaging in patients with multiple system atrophy-Parkinsonian type”的研究。该研究探索了第二代tau 正电子发射断层扫描 (PET) 示踪剂 18F-Florzolotau 在31位多系统萎缩-帕金森亚型(MSA-P)患者的显像特点,并与24位同为α-突触核蛋白疾病的帕金森病 (PD) 患者及 20 名健康对照进行比较,发现MSA-P患者较对照组在壳核、苍白球和小脑齿状核的18F-Florzolotau 摄取升高。18F-Florzolotau tau PET 成像可能反映 MSA-P的临床严重程度,可用于MSA-P和 PD的鉴别。
2022年7月,王坚教授团队申请发明专利一项——实验性帕金森病动物模型诱导组合物、试剂盒及用途,CN202210897055.1,申请人:复旦大学附属华山医院,发明人:郁文博,王坚,严雨晨,肖保国。现有的帕金森病动物模型主要基于神经毒物作用或α-突触核蛋白毒性及传播性,无法满足免疫相关PD神经损伤机制研究需要,限制了基于免疫机制的PD治疗手段开发。本发明立足于帕金森病新机制,提供完整的试剂及方案,在实验动物体内模拟帕金森病的病理生理学发展过程;由此提供实用工具,供探究PD发生发展的免疫机制、益于开发具有疾病修饰作用的PD治疗新手段。
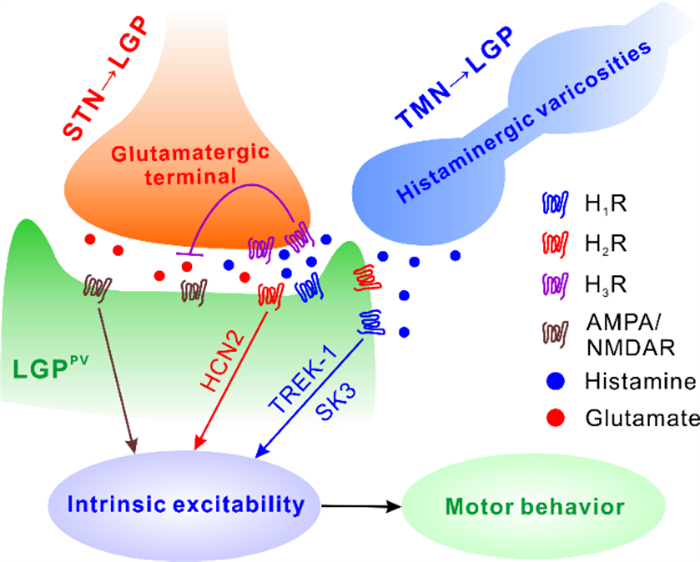
2022年12月,复旦大学附属华山医院神经外科毛颖/陈亮团队与南通大学生理系庄乾兴教授团队在《British Journal of Pharmacology》期刊发表题为“Histamine bidirectionally regulates intrinsic excitability of parvalbumin-positive neurons in lateral globus pallidus and promotes motor behavior”的文章。小清蛋白(PV)阳性神经元是外侧苍白球(LGP)中的一种神经元,在运动控制中发挥重要作用。本研究探讨了组胺双向调控LGP PV+神经元从而影响运动行为的机制。下丘脑结节乳头体核(TMN)组胺能神经纤维投射至外侧苍白球,组胺通过激活突触后组胺H1受体及其下游耦联的TREK-1和SK3通道、H2受体及其下游耦联的HCN2通道,增加LGPPV神经元的内在兴奋性;通过激活突触前组胺H3受体抑制LGPPV神经元的内在兴奋性。最后,在动物行为学水平上,通过缓释给药的方法,对外侧苍白球慢性给予组胺能药物。结果发现组胺通过激活H1受体和H2受体促进动物的运动行为,表现在动物在跑步机上的时间延长,通过平衡木的时间缩短,而激活组胺H3受体则抑制了动物的运动能力。总结:苍白球外侧核组胺能传入神经纤维通过双向调控LGPPV神经元的内在兴奋性进而影响正常动物运动行为。
2023年4月,复旦大学附属华山医院神经外科毛颖/陈亮团队与南通大学生理系庄乾兴教授团队在《PNAS》期刊发表题为“Ameliorating parkinsonian motor dysfunction by targeting histamine receptors in entopeduncular nucleus–thalamus circuitry”的文章。在帕金森病(PD)中,基底神经节中多巴胺水平的降低与神经元放电的改变和运动功能障碍有关。目前尚不清楚基底神经节神经元的放电率或模式的改变是否会导致与帕金森病相关的运动功能障碍。在本研究中,我们发现帕金森病小鼠模型中眼内核(EPN)的组胺能神经支配增加,导致EPN小清蛋白(PV)神经元的激活,通过超极化激活的环核苷酸门控通道投射到丘脑运动核团。同时,这种效应受到投射到EPN的丘脑底核(STN)谷氨酸能神经元的突触前H3R激活的负调控。这两种受体的激活都可以改善帕金森病相关的运动功能障碍。EPN的PV神经元中H2R的药理激活或HCN2的基因上调,可减少神经元的突发性放电,改善帕金森病相关的运动功能障碍,而不依赖于神经元放电率的变化。此外,在EPN投射的STN-Glu神经元中,EPN的PV神经元的光遗传抑制和药理激活或H3R的基因上调可以通过降低放电率而不是改变EPNPV神经元的放电模式来改善帕金森病相关的运动功能障碍。因此,尽管EPN-PV神经元的放电率降低和更有规律的放电模式与帕金森病相关的运动功能障碍的改善相关,但该放电模式在此背景下的放电模式似乎更为关键。这些结果也证实了在EPN的PV神经元中靶向H2R及其下游HCN2通道,在EPN投射的STN中Glu神经元中靶向H3R可能是临床治疗帕金森病相关运动功能障碍的潜在治疗策略。
